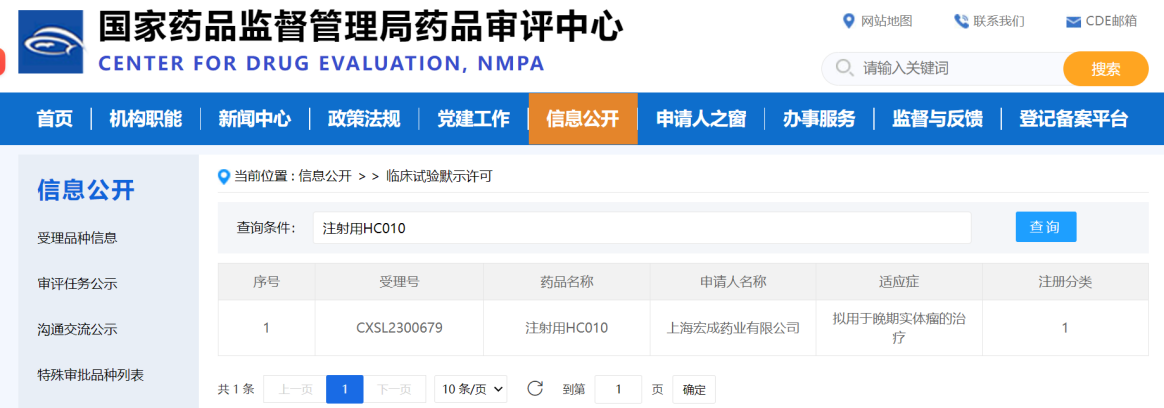
近日,倍特药业旗下上海宏成药业有限公司(以下简称“上海宏成药业”)收到国家药品监督管理局核准签发的《药物临床试验批准通知书》,批准公司自主研发的1类生物制品创新药注射用HC010开展晚期实体瘤的临床试验。该项目由上海宏成药业自主研发,是一款针对晚期实体瘤的注射用冻干制剂,靶向人PD-1、CTLA-4和VEGF的三特异性抗体,属于全球首创。公司计划在2024年第一季度启动I期临床试验。
恶性肿瘤是威胁人类健康且难以治愈的重大疾病,是人类死亡的主要原因和公共健康问题。手术治疗是早期实体瘤有效的治疗方法,但是多数肿瘤患者发现时已是晚期,治疗手段及疗效均很有限。近年来随着免疫检查点抑制剂(ICIs,immune checkpoint inhibitors)的发展,晚期肿瘤的治疗效果已经有了很大改善,但是其在多数实体瘤中的响应率较低,并且会产生获得性耐药。因此目前仍需开发新的药物,使更多患者受益。
PD-1(也称为CD279)和CTLA-4(也称为CD152),均属于免疫球蛋白超家族的免疫检查点分子。肿瘤微环境中的免疫细胞上PD-1和CTLA-4的表达升高,是肿瘤逃脱免疫监视的重要机制。
VEGF是VEGF生长因子家族的成员,VEGF与VEGFR2(KDR)结合后可以促进血管新生,在肿瘤发生中起着重要作用。抗血管新生药物,如抗VEGF抗体贝伐单抗(bevacizumab)通过阻断VEGF与其受体VEGFR2(KDR)的结合,促进血管正常化等机制抑制肿瘤的生长,在临床上用于治疗多种实体瘤。抗血管生成药物与ICIs联合应用也可起到协同作用,多个抗血管生成剂和ICIs联合用药被FDA批准用于肿瘤的治疗。目前已有多个药企启动同时阻断PD-1、CTLA-4和血管新生的联合用药的临床研究。
上海宏成药业研制的注射用HC010是一款靶向人PD-1、CTLA-4和VEGF的三特异性抗体,其设计目的是用于阻断PD-1与其配体PD-L1/L2、CTLA-4与其配体CD80/CD86以及VEGF与其受体VEGFR2之间的相互作用,同时抑制两个免疫检查点和血管新生,从而促进抗肿瘤免疫和血管正常化。
成立于2020年,上海宏成药业是倍特药业在上海张江倾力打造的高水平、高起点的研发生产型全资子公司。公司以创新为核心,致力于解决未满足的临床需求,开发FIC & BIC的全新生物药以及生物类似药,打造集创新生物药早期研究发现、临床前和临床开发、生产及商业化销售于一体的领军企业,立足中国,面向世界。
来源:倍特药业、上海宏成药业